Funktionsbeschreibung EFOY
Die Direkt Methanol Brennstoffzelle ist eine modifizierte Polymer-Elektrolyt- Membran- Brennstoffzelle, die Methanol als Energieträger verwendet um diesen direkt in elektrischen Strom umzusetzen.
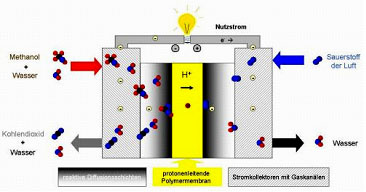
Auf dem Bild wird der elektrochemische Vorgang in einer Zelle schematisch verdeutlicht. Am Katalysator der Anodenseite wird Methanol mit Wasser oxidiert. Dabei entsteht Kohlendioxid, das aus der Zelle geführt wird, Protonen die durch die Membran transportiert werden und Elektronen die über den äußeren Nutzstromkreis geleitet werden. Die dabei entstehende elektrische Energie wird zum Betrieb elektrischer Verbraucher wie z.B. Handys oder Laptops verwendet. Auf der Kathodenseite wird aus den Protonen und Elektronen mit dem Sauerstoff der Luft Wasser gebildet. Der entstehende Dampf kann ohne Abgasaufbereitung in die Umwelt abgeleitet werden, weil die Umsetzung ohne Erzeugung von Schadstoffen abläuft.
Schritt 1
Die in zwei Kreisläufen getrennten Gase Sauerstoff an der Kathode und Methanol und Wasser an der Anode, wandern vom Gasraum in den Katalysator.
Schritt 2
Das Methanol (CH3OH) reagiert mit dem Wasser zu Kohlendioxid und Wasserstoff. Der Wasserstoff wird durch den Katalysator in zwei H+ Atome (Protonen) gespalten. Dabei gibt jedes Wasserstoffatom sein Elektron ab
Schritt 3
Die Protonen wandern durch den Elektrolyten (ProtonenleitendePolymer-Elektrolyt-Membran) zur Kathode.
Schritt 4
Die Elektronen fließen von der Anode zur Kathode und bewirken einen elektrischen Stromfluß, der einen Verbraucher mit elektrischer Energie versorgt.
Schritt 5
Jeweils vier Elektronen an der Kathode rekombinieren mit einem Sauerstoff-Molekül.
Schritt 6
Die nun entstandenen Sauerstoff-Ionen sind negativ geladen und reagieren mit den Protonen zu Wasser.

Kontakt
Exalenca Enertronik
Dipl.-Ing. Abdou Ouedraogo
Wilhelm-Hauff-Str. 12
26721 Emden
Telefon 04921-929840
Mobil 0175-8254907
E-Mail info @ exalenca.de
